学术直通车 | Uthever®被证实可减轻癌症放疗导致的肠道损伤
2023年06月06日 | 音芙 EffePharm
放射治疗是多种类型癌症的主要治疗方式之一,因为它在杀死癌细胞方面具有很高的成功率。但目前没有任何方法可以防止电离辐射对肿瘤周围健康细胞和组织造成的伤害。60-80%的腹部或盆腔癌症患者在接受放射治疗时会引发放射性肠道损伤等并发症[1]。烟酰胺单核苷酸(NMN)作为NAD+(烟酰胺腺嘌呤二核苷酸)的前体已被证实对使用者带来诸多健康益处,最新研究表明NMN补充剂可以缓解放射治疗引起的损伤及并发症。
肠道以其细胞的快速更新和增殖而闻名,这使得该器官对环境刺激的敏感性增加。接受腹部和盆腔肿瘤放射治疗的患者更容易出现早期肠道损伤表现,如腹胀、腹痛、恶心、食欲减退和急性腹泻[2]。这些症状对患者的生活质量有显著的负面影响。此外,老年人通常存在肠道结构改变,细胞再生和增殖能力下降等不利因素,可能导致他们的肠道更容易受到电离辐射治疗的影响[1,3]。
在长期癌症幸存者中,慢性肠道恶化通常发生在放射治疗后几个月至三年的时间内,并可能导致微血管硬化、肠道纤维化和黏膜萎缩。这些对肠道的损害可能危及生命[2]。
近期研究表明,肠道菌群与放射性肠道损伤之间存在着毋庸置疑的联系[1,3,4],辐射会改变肠道菌群的数量和多样性。这些改变会影响消化系统,导致腹泻和肠炎等并发症。
研究表明,电离辐射会导致有益菌的减少和有害菌的增加,导致肠道对炎症更敏感,使肠粘膜易受辐射诱导损伤[1]。肠道菌群与放射治疗的副作用密切相关。
此外,有证据表明,在放射治疗前用抗生素(无菌)预处理的小鼠受放射疗法的影响较小,这暗示着肠道菌群与放射性肠道损伤之间不可否认的关系[1,7]。
还有证据表明,将给予益生菌补充的健康小鼠的菌群,移植到长期接受放射线照射的小鼠中,可以缓解放射性急性肠道损伤[1]。
Uthever®赞助的一项研究发现,Uthever® NMN补充剂改变了腹部和盆腔癌症放射治疗引起的肠道菌群组成,并减轻了肠道纤维化[1]。该研究采用小鼠模型,对小鼠的腹部进行放射治疗,并给予NMN补充剂。辐射治疗后,收集小鼠粪便并进行16S rRNA测序以识别肠道菌群。
结果发现,长期补充Uthever® NMN改变了被电离辐射破坏的肠道菌群的组成和功能。NMN治疗使有益菌丰度增加,并抑制有害菌的增殖[1]。“肠道菌群组成的改变最终导致了其功能的变化,包括细胞过程、代谢和人类疾病”[1]。
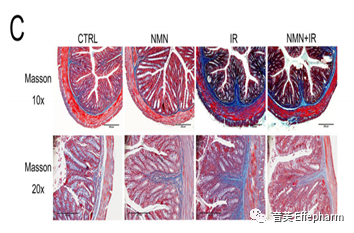
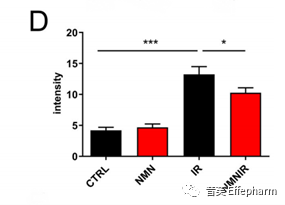
这同一个研究中还使用Masson三色染色法检测结肠组织中的胶原沉积。结果显示,电离辐射显著增加了胶原沉积,导致肠道纤维化。该研究还表明,NMN补充剂能够抑制这一过程,从而减轻肠道纤维化。
上图:显示Masson三色染色法强度的直方图[1]
由于肠道菌群与放射性肠道损伤之间存在密切关系,Uthever® NMN通过调节菌群变化成功地减弱放射治疗不利影响及保护肠道菌群的方式,降低了电离辐射引起的肠道损伤风险并缓解其副作用[1]。
2. NRF2:通过增强抗氧化和DNA修复机制减轻放射性肠道损伤
用于治疗癌细胞的放射治疗原理是利用电离辐射(IR)破坏癌细胞。IR可以诱导产生活性氧自由基(ROS)或直接作用于基因组,诱发癌细胞的DNA损伤。电离辐射引起水分子的辐解,产生多种自由离子、电子和自由基,包括羟基自由基(-OH),增加氧化应激并进一步引发DNA损伤[5,6]。这些辐射也会损伤周围的正常细胞和组织。对于腹部和盆腔癌症放射治疗,IR通常会加速肠道损伤并导致不良反应。老年人群受影响更加严重,因为他们的抗氧化和DNA修复系统随着年龄增长而减弱。
一种名为核因子红细胞2相关因子2(NRF2)的转录因子与DNA中的抗氧化应答元件(ARE)结合,并调节与DNA修复和抗氧化系统相关的基因的表达。因此,NRF2诱导剂已被用作强效抗氧化药物,以治疗放射治疗引起的疾病[8,9]。
Sirtuins是一类与衰老和长寿密切相关的蛋白质。它们还参与支持抗氧化和DNA修复系统。例如,SIRT1、SIRT6和SIRT7是在细胞核中发现的sirtuin家族的三个成员,它们可能通过与NRF2相互作用来调节抗氧化基因的表达。科学研究已经发现SIRT1、SIRT6和SIRT7在DNA损伤应答过程中起到一定作用。
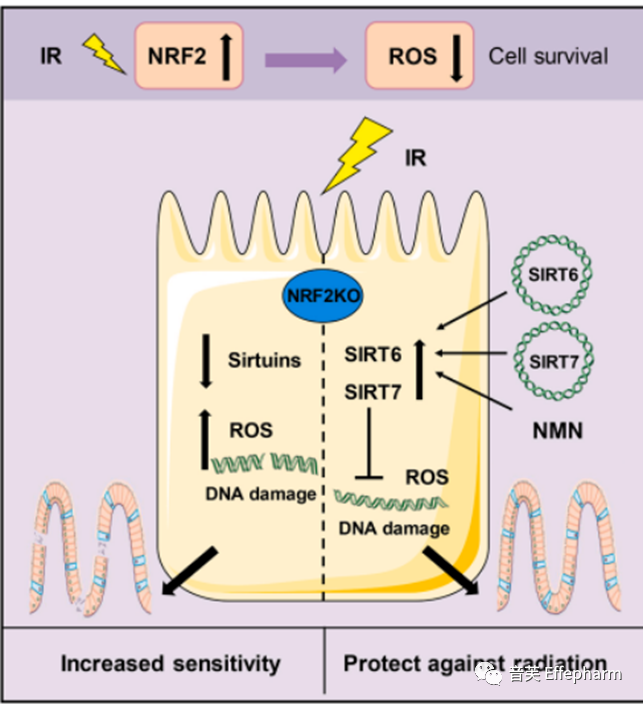
由Uthever®赞助的另一项研究发现,通过NMN补充可以提升NRF2水平,为减轻IR引起的损害提供了有希望的解决方案。NMN对NRF2具有激活作用。这项通过对小鼠进行的研究,评估了Uthever® NMN对减轻放射治疗引起的肠道损伤的影响,发现降低或抑制NRF2水平会增加活性氧自由基(ROS)水平,使体内组织对辐射更加敏感,最终增加了IR引起副作用的严重性[6]。此外,该研究证实补充Uthever® NMN可以逆转损伤,并通过修复DNA损伤和减轻由癌症放射治疗引起的肠道损伤提供保护效应。
部分依赖NAD+的sirtuin家族成员(SIRT1-7,例如SIRT1、2、3等)是与NRF2一起在身体内发挥作用的。NMN对这些蛋白质也具有协同效应。研究发现补充Uthever® NMN同样增强了对此类蛋白质的作用[6]。
上图:NMN减轻了IR引起的DNA损伤和肠道损伤[6]
补充SIRT7和SIRT6以及NMN可以逆转损伤,并通过修复DNA和减轻由癌症放射治疗引起的肠道损伤来提供保护效应。
综上所述,Uthever® NMN补充剂有调节肠道菌群和提升NRF2水平的功效,显示出减轻放射治疗引起的辐射损伤和并发症的巨大潜力。这些研究结果为放射治疗患者提供了一种潜在的辅助治疗方法,以改善其生活质量并减少治疗不良影响。然而,需要进一步的研究来验证这些发现,并评估Uthever® NMN补充剂在临床条件下的效果和安全性。
NMN很可能是解锁当今诸多与健康相关问题进展的一把钥匙。NMN在皮肤治疗、抗衰老和抗感染等其他健康领域的作用将成为未来科学研究的重点。
[1] Zhao, X.; Ji, K., Zhang, M.; Huang, H.; et al (2022). NMN alleviates radiation-induced intestinal fibrosis by modulating gut microbiota. International Journal of Radiation Biology, 1-12.
[2] Hauer-Jensen, M., Denham, J. W., & Andreyev, H. J. N. (2014). Radiation enteropathy—pathogenesis, treatment and prevention. Nature reviews Gastroenterology & hepatology, 11(8), 470-479.
[3] Martin, K., Potten, C. S., Roberts, S. A., & Kirkwood, T. B. (1998). Altered stem cell regeneration in irradiated intestinal crypts of senescent mice. Journal of cell science, 111(16), 2297-2303.
[4] Nam YD, Kim HJ, Seo JG, Kang SW, Bae JW. 2013. Impact of pelvic radiotherapy on gut microbiota of gynecological cancer patients revealed by massive pyrosequencing. PLoS One. 8(12):e82659
[5] Bai, J., Barandouzi, Z. A., Rowcliffe, C., Meador, R., Tsementzi, D., & Bruner, D. W. (2021). Gut microbiome and its associations with acute and chronic gastrointestinal toxicities in cancer patients with pelvic radiation therapy: a systematic review. Frontiers in oncology, 11, 5237.
[6] Zhao, X., Zhang, M., Wang, J., Ji, K., Wang, Y., Sun, X., & Liu, Q. (2022). NMN ameliorated radiation induced damage in NRF2-deficient cell and mice via regulating SIRT6 and SIRT7. Free Radical Biology and Medicine, 193, 342-353.
[7] Crawford PA, Gordon JI. 2005. Microbial regulation of intestinal radiosensitivity. Proc Natl Acad Sci U S A. 102(37):13254–13259
[8] Wei, J. et al. (2021) “Sulforaphane-mediated Nrf2 activation prevents radiation-induced skin injury through inhibiting the oxidative-stress-activated DNA damage and NLRP3 inflammasome,” Antioxidants (Basel, Switzerland), 10(11), p. 1850. doi: 10.3390/antiox10111850.
[9] Nakagami, Y. (2017) “Nrf2 activators as therapy for acute radiation dermatitis,” Journal of Rare Diseases Research & Treatment, 2(3), pp. 11–15. Doi: 10.29245/2572-9411/2017/3.1109.